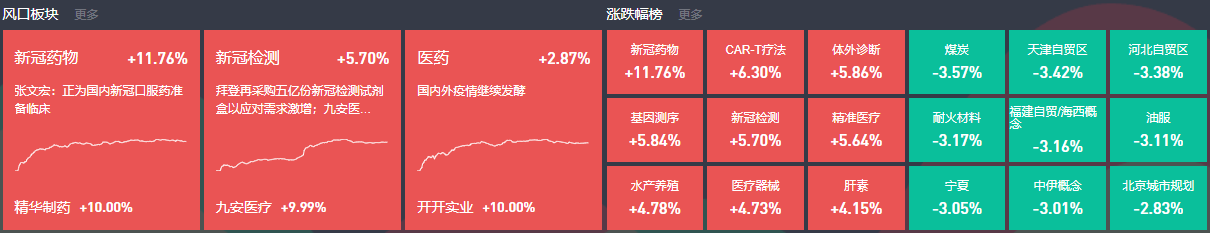
我國加速批準境外新藥上市取得進展。國家藥監局局長焦紅22日在國務院政策例行吹風會上表示,今年4月以來,國家藥監局加速批準了臨床急需的7個防治嚴重危及生命疾病的境外新藥,其中包括預防宮頸癌的九價HPV疫苗、治療丙肝的第三代索磷布韋帕他韋片。
焦紅介紹,通過大幅簡化境外上市新藥審批程序、優化藥品臨床試驗審批程序、取消進口化學藥品逐批強制檢驗,國家藥監局加快臨床急需藥品審評審批,實施鼓勵新藥上市政策措施。
對于境外已上市的防治嚴重危及生命且無有效治療手段疾病以及罕見病的藥品,同時經研究確認不存在人種差異的,申請人不需要申報臨床試驗,可直接以境外試驗數據申報上市,藥品上市時間將加快1至2年;對需要在我國開展臨床試驗的境外新藥,將臨床試驗階段的注冊檢驗由逐一檢驗調整為根據審評需要檢驗,縮短企業檢驗樣品的準備時間,加速境外新藥上市。
國家藥監局起草的《關于調整藥物臨床試驗審評審批的公告(試行)》目前正在公開征求意見。該公告正式實施后,臨床試驗申請由批準制改為到期默認制,自臨床試驗申請受理之日起60日內,未收到否定或質疑意見的,申請人即可按照提交的方案開展臨床試驗,為企業節約時間成本。
今年4月,國家藥監局發布《關于進口化學藥品通關檢驗有關事項的公告》,取消了進口化學藥品的口岸檢驗,加強上市后的監督抽驗。政策實施后,進口化學藥品從口岸通關后可直接配送至醫療機構、零售藥店,可縮短進入中國市場時間2至3個月,降低境外新藥進入中國市場的成本。
焦紅表示,下一步要加強職業化檢查員隊伍建設,加強事中事后監管,加大境外檢查力度,讓國際醫藥創新成果盡快惠及我國患者。
相關閱讀:
世界各國均對藥品實施嚴格的市場準入管理。今年以來,我國在加快臨床急需的境外上市新藥審評審批上取得顯著進展。在國新辦22日舉行的國務院政策例行吹風會上,國家藥監局有關負責人介紹了境外新藥加快審批、加強監管等方面的情況。
新化月報網報料熱線:886 2395@qq.com
最近更新
- 市政協委員建議推動出臺《重慶市民營企業發展促進條例》高質量集聚發展“專精特新”中小企業2022-01-15
- 噴灑消毒劑2.9噸!鶴壁鶴山區對城區公共場所集中消殺2022-01-15
- 大慶兩會看檢察 | 漫看大慶檢察“高光”時刻(一)2022-01-15
- @所有焦作人 坐火車不用再帶身份證了2022-01-15
- 從警前VS從警后,一同追憶那段“芳華”!2022-01-15
- 速看!福州這個路段出行有變2022-01-15
- 【長三角日報】紹興原市委書記馬衛光,任杭州市政協黨組書記2022-01-15
- 西安市新城區發布關于在外人員返鄉有關事項的通告2022-01-15
- 大幅提速!長春中院首次適用二審民事案件獨任制審判2022-01-15
- 天津津南檢察:“既要抓好防疫,也要辦好案件”2022-01-15
- 豫警文苑丨黑夜卡口,藏著最深的愛和最亮的光2022-01-15
- 全省法院實現訴訟費繳退費“線上辦” 傳統線下繳退費功能為何仍保留?2022-01-15
- 受疫情影響西安部分區縣蔬菜滯銷,亟需各方助力解決2022-01-15
- 恩施州6個重大交通運輸項目集中開工!總投資32億元2022-01-15
- 【15號用】3崗招聘若干人!45歲以下可報!五險一金+包食宿!2022-01-15
- 國際科技合作助推湖南優勢領域提升國際競爭力2022-01-15
- 延安城區新增車位3100個 有效破解停車難2022-01-15
- 鴻星爾克入選2021年“誠信之星”!2022-01-15
- 菏澤農商行新興支行開展包片行政村信貸產品推介活動2022-01-15
- 鞏義市:黨員“雙報到”進社區 為民服務“不打烊”2022-01-15
- 廣東珠海1月15日新報告1例本土確診病例2022-01-15
- 大降價!阜陽即將啟動2022-01-15
- 北京專報丨國家衛健委:天津疫情仍在持續發展,西安疫情進入收尾階段2022-01-15
- 陜西對符合解除隔離條件人員 落實后續7天居家健康監測措施2022-01-15
- 信陽消防聯合多部門 開展應急實戰演練2022-01-15
- 城西區:“紅色存折”讓社區志愿服務更有溫度2022-01-15
- 乘動車忘帶身份證 可開電子證明2022-01-15
- 陜西組建2400人的省級醫療團隊 支援本土確診病例救治工作2022-01-15
- “德爾塔”與“奧密克戎”,救治有何不同?2022-01-15
- 手拉手共成長 長沙清水塘北辰小學孩子“牽手”湘西娃2022-01-15